En la célula nerviosa en reposo, como vimos en la entrada Potencial de membrana, el flujo constante hacia dentro de sodio, se ve equilibrado con el flujo constante de potasio hacia fuera de la célula, de forma que el potencial de membrana es también constante.
Esta situación, sin embargo, se ve alterada cuando la membrana se depolariza más allá del umbral para generar un potencial de acción. Una vez que el potencial de membrana alcanza este umbral, muchos canales de sodio, sensibles a voltaje (estos canales son diferentes a los que se encontraban abiertos durante el reposo, ya que aquellos no requieren de estímulo para su activación) se abren, permitiendo el paso de sodio al interior de la célula. Este flujo supera al de salida de potasio, por lo tanto, la membrana celular se despolariza aún más. A su vez, este aumento en la despolarización, permite que se abran aún más canales de sodio, lo que acelera la despolarización. Como la entrada de iones sodio, supera por lejos la salida de iones potasio, el potencial de membrana se ve prácticamente sólo afectado por el sodio, arrastrando el potencial de membrana al potencial de equilibrio del sodio, el que es aproximadamente +55 mV. Sin embargo, es necesario tener presente, que el potencial de membrana nunca va a alcanzar complemente este valor, ya que el flujo de potasio hacia fuera de la célula continúa y también se produce un leve incremento de la entrada de cloruro, lo que hace que el potencial de membrana sea un poco menor que el potencial de equilibrio de sodio.
El potencial de membrana seguiría teniendo este valor positivo, cercano al potencial de equilibrio del sodio, si no fuera por dos situaciones:
- Los canales de sodio sensibles a voltaje, sufren inactivación.
- La apertura de canales de potasio sensibles a voltaje determinan que aumente gradualmente el flujo de salida de K+. El aumento de la permeabilidad de potasio es más lento que la del sodio, debido al índice más lento de apertura de los canales de potasio sensibles a voltaje.
De este modo, el aumento retardado del flujo de potasio hacia el exterior celular, sumado a la inactivación de los canales de sodio sensibles a voltaje y por ende la disminución en la conducción de sodio al interior celular, provocan la repolarización paulatina de la célula, o sea, la recuperación de su potencial de reposo (potencial de equilibrio de la membrana celular en ausencia de estímulo).
En este vídeo se muestra un resumen de lo explicado anteriormente, es bastante didáctico.
Los experimentos que demostrarían lo descrito anteriormente fueron realizados por medio del sistema de voltage clamp o pinzamiento de voltaje. La función básica del este método es interrumpir la interacción entre el potencial de membrana y la apertura y cierre de canales de membrana sensibles a voltaje. El mantenimiento del voltaje lo realiza inyectando corriente en la célula, la que es igual y opuesta a la que fluye a través de los canales de iones sensibles a voltaje.
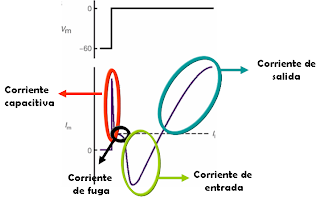
Un experimento típico de voltage clamp, comienza con el mantenimiento del potencial de membrana en su potencial de reposo. Si se envía un potencial de despolarización de 10 mV se observará una descarga muy breve de salida correspondiente a la corriente capacitiva. Esta corriente va seguida de otra, también de salida, más pequeña y que persiste durante todo el pulso despolarizante (ver figura 1). Al final del pulso se puede ver una pequeña corriente de entrada. Esta corriente corresponde a la capacitiva nuevamente. Luego de esto, la corriente de la membrana regresa a cero.
La corriente iónica que se ve luego de la capacitiva, es la llamada corriente de fuga o corriente de leak. Ésta, se produce gracias a los canales de reposo, que siempre están abiertos (aún en ausencia de estímulo) y que además son los responsables del potencial de reposo de la membrana celular.
Si se envía una pulsación de despolarización mayor, entonces el registro de la corriente se complica un poco. Por una parte, la amplitud de la corriente capacitiva y la de fuga, aumentan. Además como puedes observar de la figura 2, luego de la corriente capacitiva de salida y al comienzo de la de fuga, se produce una corriente de entrada, la que se mantiene durante unos pocos milisegundos para dar lugar a una gran corriente de salida. Esta corriente de salida se mantendrá durante todo lo que dure el pulso.
Los canales de sodio y de potasio sensibles a voltaje, presentan algunas similitudes como que a medida que aumenta la despolarización, ambos aumentan su probabilidad de apertura y su velocidad de apertura. Sin embargo, también presentan diferencias además de su selectividad, ya que difieren en cuanto a su velocidad de apertura y a su respuesta frente a una despolarización prolongada. Siempre, frente a cualquier despolarización, los canales de sodio se van a abrir más rápido que los canales de potasio sensibles a voltaje. Además, frente a una despolarización prolongada, los canales de sodio dejan de conducir debido a que sufren inactivación. Al contrario, los canales de potasio no se inactivan, sino que permanecen abiertos todo el tiempo que la membrana está despolariza
En este vídeo se muestra un resumen de lo explicado anteriormente, es bastante didáctico.
¿Cómo podemos determinar cuáles son los iones involucrados en el potencial de acción?
La primera respuesta a esta pregunta, surgió de Alan Hodgkin y Bernard Katz, quienes hallaron que la amplitud del potencial de acción disminuye cuando se reducen las concentraciones de sodio externas, lo que indica que el flujo de sodio hacia el interior celular es el responsable de la fase de elevación del potencial de acción. Sus datos también revelaron la participación del potasio en la fase de caída del potencial de acción. De este modo, Hodgkin y Katz propusieron que la despolarización de la célula causaría un breve incremento de la permeabilidad de la membrana celular para el sodio, durante el cual superaría a la dominante en la membrana celular en reposo para los iones de potasio. Los experimentos que demostrarían lo descrito anteriormente fueron realizados por medio del sistema de voltage clamp o pinzamiento de voltaje. La función básica del este método es interrumpir la interacción entre el potencial de membrana y la apertura y cierre de canales de membrana sensibles a voltaje. El mantenimiento del voltaje lo realiza inyectando corriente en la célula, la que es igual y opuesta a la que fluye a través de los canales de iones sensibles a voltaje.
Un experimento típico de voltage clamp, comienza con el mantenimiento del potencial de membrana en su potencial de reposo. Si se envía un potencial de despolarización de 10 mV se observará una descarga muy breve de salida correspondiente a la corriente capacitiva. Esta corriente va seguida de otra, también de salida, más pequeña y que persiste durante todo el pulso despolarizante (ver figura 1). Al final del pulso se puede ver una pequeña corriente de entrada. Esta corriente corresponde a la capacitiva nuevamente. Luego de esto, la corriente de la membrana regresa a cero.
Si se envía una pulsación de despolarización mayor, entonces el registro de la corriente se complica un poco. Por una parte, la amplitud de la corriente capacitiva y la de fuga, aumentan. Además como puedes observar de la figura 2, luego de la corriente capacitiva de salida y al comienzo de la de fuga, se produce una corriente de entrada, la que se mantiene durante unos pocos milisegundos para dar lugar a una gran corriente de salida. Esta corriente de salida se mantendrá durante todo lo que dure el pulso.
Figura 2, una despolarización mayor induce corrientes capacitivas y de fuga más grandes, más una corriente de entrada y otra de salida.
Una explicación para este resultado es que la despolarización de membrana produce la apertura de dos canales por separado, uno que promoverá el flujo de iones hacia dentro de la célula y otro que promoverá la salida de iones de la célula.
Para poder determinar de qué iones se trataba y por ende, qué canales son lo que se abren, Hodgkin y Huxley comenzaron por reemplazar el sodio extracelular por un catión más grande y no permeable, como la colina. Con esto, fueron capaces de eliminar la corriente de entrada y pudieron determinar que ésta efectivamente era producida por el ion sodio. Posteriormente utilizaron bloqueadores, como tetrodotoxina (TTX). Esta molécula es un veneno procedente de un tipo de pez globo, el cual bloquea selectivamente los canales de sodio dependientes de voltaje con una potencia muy elevada en el orden de nanomoles.
Otro bloqueador sumanente importante en biofísica es el tetraetilamonio (TEA). Esta molécula es un bloqueador selectivo de los canales de potasio sensibles a voltaje, de modo que al aplicar TEA al axón, se puede ver una pérdida de la corriente de salida correspondiente al potasio (figura 3).
Figura 3: Si se despolariza la célula en presencia de tetrodotoxina (TTX) que bloquea las corrientes de sodio y luego en presencia de tetraetilamonio (TEA) que bloquea la corriente de potasio, podemos ver que se pierde la corriente de entrada y de salida respectivamente.Los canales de sodio y de potasio sensibles a voltaje, presentan algunas similitudes como que a medida que aumenta la despolarización, ambos aumentan su probabilidad de apertura y su velocidad de apertura. Sin embargo, también presentan diferencias además de su selectividad, ya que difieren en cuanto a su velocidad de apertura y a su respuesta frente a una despolarización prolongada. Siempre, frente a cualquier despolarización, los canales de sodio se van a abrir más rápido que los canales de potasio sensibles a voltaje. Además, frente a una despolarización prolongada, los canales de sodio dejan de conducir debido a que sufren inactivación. Al contrario, los canales de potasio no se inactivan, sino que permanecen abiertos todo el tiempo que la membrana está despolariza
Figura 4: los experimentos de voltage clamp muestran que los canales de sodio se abren muy rápidamente, pero se inactivan frente a un pulso prolongado, mientras que los canales de potasio, muestran un aumento en su conductancia más lento, pero se mantiene todo el tiempo que se da el pulso de corriente.
Por lo tanto, con la figura 4 nos podemos dar cuenta que los canales de sodio sensibles a voltaje sufren tres transiciones frente a una despolarización: CERRADO-ABIERTO-INACTIVADO.
Con la despolarización, el canal de sodio pasa de un estado cerrado al estado abierto. Si la despolarización es breve, los canales de sodio vuelven inmediatamente al reposo, mientras que si se mantiene el pulso despolarizante, el proceso que continúa al estado abierto es el estado inactivado. Una vez que el canal se inactiva, NO se vuelve a activar con una nueva despolarización. La inactivación puede ser revertida solamente con una hiperpolarización, es decir, con un potencial de reposo muy negativo, que permite al canal pasar del estado inactivo al cerrado. Este cambio, además, requiere algún tiempo, porque los canales abandonan el estado inactivado de una forma relativamente lenta.
Los canales de sodio dependientes de voltaje, presentan dos clases de compuerta, cuya apertura simultánea permite el flujo de corriente. Cuando la membrana está en un potencial negativo de reposo, hay una compuerta de activación que se mantiene cerrada, mientras que la compuerta de inactivación se encuentra abierta y se cierra lentamente frente a una despolarización. Esto provoca que el canal no conduzca sino sólo durante un breve periodo de la despolarización, en el que ambas compuertas estarán abiertas. La repolarización invierte ambos procesos, o sea, cierra rápidamente la compuerta de activación y abre lentamente la de inactivación.
Figura 5: Los canales de sodio sensibles al voltaje tienen dos compuertas, que responden de forma opuesta a la despolarización. En estado de reposo (cerrado), la compuerta de activación está cerrada y la de inactivación abierta (1). Con la despolarización, la puerta de activación se abre mientras que la de inactivación se cierra lentamente. Durante el tiempo que demora la puerta de inactivación en cerrarse, se produce el flujo de iones de sodio al interior celular (2). Cuando se cierra la compuerta de inactivación, los canales entran en estado inactivado (3). Con la repolarización, primero se cierra la compuerta de activación y luego se abre la de inactivación (1).
Resumen: El estado de despolarización del potencial de acción limita entonces la duración de éste de dos maneras:
Resumen: El estado de despolarización del potencial de acción limita entonces la duración de éste de dos maneras:
- inactivando de forma gradual los canales de sodio y reduciendo la conductancia del sodio.
- abriendo, con cierto retraso, los canales de potasio sensibles a potencial, con lo que aumenta la conductancia de potasio.
En consecuencia, la corriente de sodio hacia dentro va seguida de la corriente de potasio hacia fuera que tiende a repolarizar la membrana. En la mayoría de las células nerviosas, se produce una hiperpolarización posterior al potencial de acción. Este aumento de potencial, muy breve, se produce porque los canales de potasio que se abren durante el potencial de acción, se cierran incluso un tiempo después de que el potencial de membrana haya vuelto a su valor de reposo.
El potencial de acción va seguido de un breve periodo de menor excitabilidad, o refractario, el que se puede dividir en dos fases:
- Periodo refractario absoluto: se produce inmediatamente después del potencial de acción. Durante este periodo es IMPOSIBLE excitar la célula, sin importar cuan grande sea la despolarización.
- Periodo refractario relativo: este periodo sigue inmediatamente al refractario absoluto. Durante éste, es posible desencadenar un potencial de acción siempre y cuando el estímulo que se aplique, sea mayor al que se necesita para lograr normalmente el umbral.
Otra regla importante en el potencial de acción, es la del todo o nada, donde un milivoltio puede provocar la diferencia entre la generación o no de un potencial de acción. Esta diferencia se produce gracias al mayor número de canales de sodio sensibles a voltaje, frente a los canales de potasio.
Inactivación de canales de sodio dependientes de voltaje
Hodgkin y Huxley desarollaron un tipo de experimento para caracterizar el proceso de inactivación, conocido como protocolo de doble pulso. Para entenderlo mejor, pondré un ejemplo (figura 6). Supongamos un primer pulso que varíe entre-90 a -30 mV y un segundo pulso que se mantenga siempre en 0 mV. Cuando exista inactivación en los canales, se verá que mientras mayor sea la despolarización provocada por el primer pulso largo, menor será la corriente durante el segundo pulso, ya que aumenta el número de canales inactivados. El efecto del primer pulso se desarrolla con el tiempo, donde la inactivación será mínima a tiempos cortos y se hará más pronunciada a medida que el prepuso se alarga. Este protocolo se puede hacer con diferentes amplitudes del prepulso para determinar de este modo las constantes de tiempo de la inactivación en función del potencial de membrana.
Inactivación de canales de sodio dependientes de voltaje
Hodgkin y Huxley desarollaron un tipo de experimento para caracterizar el proceso de inactivación, conocido como protocolo de doble pulso. Para entenderlo mejor, pondré un ejemplo (figura 6). Supongamos un primer pulso que varíe entre
Figura 6: protocolo de doble pulso para determinar inactivación en función del potencial de membrana, donde se muestra un primer pulso o prepulso largo, para favorecer la inactivación.
La inactivación sólo se recupera con una hiperpolarización y en transcurso del tiempo. Por este motivo, otro protocolo de doble pulso permite medir la recuperación de la inactivación. Para esto, se aplican dos pulsos de igual magnitud como los mostrados en la figura 7, donde se varía el tiempo entre los pulsos.

Figura 7: Experimento de dos pulsos desde su analiza la recuperación de la inactivación de los canales. Luego del primer pulso se regresa a un potencial hiperpolarizante como es el Vm.
Lo que deberíamos esperar de este protocolo, es que mientras más largo sea el tiempo entre los pulsos, mayor sea la recuperación de la inactivación de los canales de sodio. De tal forma, en caso que el tiempo sea suficiente para recuperar la inactivación de todos los canales, la corriente del segundo pulso sería igual en magnitud a la del primer pulso.
La inactivación sólo se recupera con una hiperpolarización y en transcurso del tiempo. Por este motivo, otro protocolo de doble pulso permite medir la recuperación de la inactivación. Para esto, se aplican dos pulsos de igual magnitud como los mostrados en la figura 7, donde se varía el tiempo entre los pulsos.

Figura 7: Experimento de dos pulsos desde su analiza la recuperación de la inactivación de los canales. Luego del primer pulso se regresa a un potencial hiperpolarizante como es el Vm.
Lo que deberíamos esperar de este protocolo, es que mientras más largo sea el tiempo entre los pulsos, mayor sea la recuperación de la inactivación de los canales de sodio. De tal forma, en caso que el tiempo sea suficiente para recuperar la inactivación de todos los canales, la corriente del segundo pulso sería igual en magnitud a la del primer pulso.







Sabemos que el tetraetilamonio es un bloqueador de canales de potasio, pero cuál es el fenómeno mecanístico que esta ocurriendo en el canal?
ResponderEliminarAntes que todo, pido disculpas por el enorme retraso de mi respuesta.
ResponderEliminarBueno, respecto a tu pregunta te puedo contar que el sitio de unión del TEA a los canales de potasio se ha venido estudiando desde 1990 aproximadamente. Por ese tiempo, se realizaron varias mutaciones, las que finalmente concluyeron en que el residuo aminoacídico ubicado en la posición 449 en el canal de potasio Shaker era fundamental en el bloqueo externo del TEA (MacKinnon and Yellen, 1990; Kavanaugh et al., 1991; Heginbotham y MacKinnon, 1992). Este residuo se encuentra localizado en la región del poro, en el vestíbulo externo del canal de potasio cercano al filtro de selectividad. Además, en otros canales de potasio también se sustituyeron aminoácidos equivalentes a la posición 449 alterando de igual modo la eficacia de bloqueo de TEA en un rango que iba desde 0.6 mM a 100 mM cuando el aminoácido en cuestión no se sustituía por un aminoácido cargado positivamente, ya que en este caso TEA dejaba de actuar como bloqueador. La verdad es que con estos antecedentes se podría pensar que se trata de una cuestión electroestática, sin embargo cuando la sustitución se realizaba por algún aminoácido neutro eléctricamente también se conseguía que TEA bloqueara el canal (MacKinnon and Yellen, 1990). Además, existen otros antecedentes que indican que una sustitución por una carga negativa, como el caso de un glutamato generaba que el canal se volviera insensible a TEA (Molina et al., 1997), lo que no concuerda con una interacción meramente electroestática.
Otros antecedentes publicados por Heginbotham y MacKinnon en 1992, concluyen que al reemplazar el aminoácido 449 por tirosina, el bloqueo por TEA se vuelve 30 veces más eficiente. Esto llevó a suponer que TEA se coordinaría con los grupos aromáticos, los que formarían una especie de jaula que uniría al bloqueador mediante interacciones pi-catión.
Finalmente otro dato que te puedo aportar es que otros autores coinciden en que el TEA se uniría al vestíbulo externo y que el residuo 449 o sus equivalentes en otros canales de potasio, serían importantes en la función de la molécula como bloqueador, sin embargo ellos descartan la posibilidad que TEA se pueda unir directamente a estos residuos. Lo que ellos proponen es que sería más bien la topografía y las características del ambiente que presenta el vestíbulo externo lo que estabilizaría el TEA permitiendo el bloqueo del canal (Korn et al., 2004). Esta observación sería consistente con la extrema rapidez del TEA como bloqueador (Spruce et al., 1987).
Existe mucha información respecto al mecanismo por el cual TEA se une al canal y me comprometo a crear una entrada más detallada de los antecedentes con los que se cuenta, de todos modos puedes ampliar la información revisando los artículos que puse como referencia, si tienes problemas en la descarga, te los puedo enviar.
hola q tal muy interesante tu blog pero tengo una duda:
ResponderEliminar¿¿por que un aumento en la concentracion de potasio extracelular causa debilidad y flaccides del musculo cardiaco si se supone q al aumentar la concentracion de K+ extracelular, se despolariza la membrana y por tanto habria contraccion en vez de flaccides???
felipese@live.cl ese es mi correo ojala m contestes por fa
Lautaro, publiqué una entrada donde trato de aclarar la duda. Te dejo el link
ResponderEliminarhttp://acercandolabiofisica.blogspot.com/2010/08/por-que-un-aumento-en-la-concentracion.html
Gracias por la pregunta, espero que te quede más claro. Siento la demora. Saludos.
Hola que síntomas presentaría una persona como respuesta a una intoxicación por TTX??
ResponderEliminarLos síntomas y la velocidad con la que estos aparecen dependerán de la cantidad de TTX ingerido. De todos modos, la parestesia es típicamente el primer síntoma que comienza normalmente una hora después de ingerida la toxina. Inicialmente afecta la lengua, labios, boca y avanza involucrando las extremidades. Síntomas gastrointestinales también se pueden observar (náuseas y vómitos). Si se ha ingerido una cantidad importante de toxina, el paciente desarrollará una parálisis flácida, bradicardia, hipotensión y bloqueo cardiaco. Como ves, es una toxina altamente peligrosa, por lo que debe ser manipulada bajo estrictas normas de seguridad. Saludos!
EliminarComo es el procedimiento del bloque d e los canales de sodio y como impide los potenciales de accion la TTX
ResponderEliminarHola!
EliminarGracias leer y participar de este blog.
Bueno, respondiendo a tu pregunta te cuento lo siguiente:
La tetrodotoxina o TTX es un bloqueador del canal de sodio. Existe un residuo aminoacídico particular en la región del poro del canal (del dominio I), que da cuenta de la sensibilidad del canal por la toxina. Este residuo es un aminoácido aromático (Tirosina) ubicado en la posición 401. Cuando este residuo es mutado, el canal se vuelve resistente a esta toxina. Si necesitas más información, puedes leer artículo (si no puedes acceder a él y te interesa, me informas y te lo envío)
http://www.sciencemag.org/content/257/5067/248.short.
Ahora bien, respecto a cómo la unión de TTX al canal impide el potencial de acción, la respuesta es más bien sencilla. La toxina se une al poro del canal, por lo que por él no pueden entrar sodio a la célula. De este modo, no se produce la despolarización requerida para activar a los canales de potasio dependientes de voltaje con lo que no se produce el disparo del potencial de acción.
Espero que te haya aclarado la duda y si necesitas material o quieres profundizar más en el tema, no dudes en contarme.
Saludos!
Hola!
ResponderEliminarLei de mil libros y de mil páginas y vi videos en youtube, pero todavia me cuesta el concepto de pinzamiento de voltaje.
Alguna otra explicación mas sencilla?? graciasss
Hola Flor,
Eliminarbásicamente la técnica de pinzamiento de voltaje o (voltage clamp) consiste en mantener el potencial fijo en una célula completa o en un trozo de membrana, para poder estudiar el funcionamiento de los canales frente a determinados potenciales con los que tú estimulas. Normalmente se aplican pulsos de voltaje que duran algunos milisegundos lo que te permite estudiar la magnitud de la corriente de un conjunto de canales o de un canal único.Recuerda que hay canales que se abren a potenciales negativos (rectificadores de entrada), o a voltajes positivos (rectificadores de salida) o también los hay de tipo ohmico, cuya corriente varía de forma lineal con el voltaje.
Te puedo ayudar con ésto, pero me gustaría hacer una entrada para poder dar una explicación más completa. Espero que tengas algo de tiempo. Me comprometo a tenerla lista lo antes posible.
Saludos!
Hola.
ResponderEliminar¿Cómo se denominan las corrientes que circulan por el medio extracelular como consecuencia de la descarga de un potencial de acción?
Hola Daniel.
EliminarEstas corrientes que mencionas, recibirán el nombre del ión que salga al medio extracelular, como por ejemplo corriente de potasio ya que en este caso, será la corriente mayoritaria.
Saludos!