Hace más de 100 años, Sherrington (Levine, 2007) propuso la existencia del nociceptor, es decir, neuronas sensoriales primarias que traducen estímulos nocivos en potenciales de acción y que conducen esta señal eléctrica desde su sitio de estímulo hasta la médula espinal. Más tarde, estudios electrofisiológicos determinaron que efectivamente existían tales neuronas, las cuales podían ser estimuladas por ejemplo mediante un calor nocivo, una presión intensa o por químicos que pudieran provocar irritación.
Figura 1: Diferentes nociceptores detectan diferentes tipos de dolor. A. nervios periféricos incluyen fibras aferentes mielinizadas de pequeño (Ad), medio y gran diámetro ( Ab), así como fibras aferentes no mielinizadas de pequeño diámetro (fibras C). B.La velocidad de conducción está directamente relacionada al diámetro de las fibras. Imagen tomada de Julius and Basbaum, 2001.
Todos los sistemas sensoriales, vista, tacto, oído, gusto y olfato, pueden convertir un estímulo ambiental en una señal eléctrica. Por lo general, las neuronas sensoriales primarias sólo pueden detectar un estímulo, como luz, olores, sonidos, etc, sin embargo, el caso de la nocicepción es único, ya que debe detectar una amplia modalidad de estímulos los que pueden ir desde un estímulo químico nocivo como algún tipo de daño causado por un ácido hasta alguna temperatura perjudicial. Además, los nociceptores no sólo están encargados de sentir estímulos dolorosos, sino que también contribuyen en condiciones de dolor patológicas y persistentes (alodinia) las que ocurren luego de habernos causado algún daño. Por ejemplo, cuando sufrimos una quemadura, pasado el tiempo dejamos de sentir ese dolor punzante, sin embargo, si nos tocamos en la zona dañada es probable que nuevamente un simple roce que en condiciones normales no nos provocaría dolor, ahora genere daño. La alodinia puede resultar de dos condiciones diferentes:
- Incremento en la respuesta de las neuronas encargadas del dolor, ubicadas en la médula espinal (sensibilización central).
- Disminución en los umbrales de activación de los nociceptores (sensibilización periférica).
Todos los sistemas sensoriales, vista, tacto, oído, gusto y olfato, pueden convertir un estímulo ambiental en una señal eléctrica. Por lo general, las neuronas sensoriales primarias sólo pueden detectar un estímulo, como luz, olores, sonidos, etc, sin embargo, el caso de la nocicepción es único, ya que debe detectar una amplia modalidad de estímulos los que pueden ir desde un estímulo químico nocivo como algún tipo de daño causado por un ácido hasta alguna temperatura perjudicial. Además, los nociceptores no sólo están encargados de sentir estímulos dolorosos, sino que también contribuyen en condiciones de dolor patológicas y persistentes (alodinia) las que ocurren luego de habernos causado algún daño. Por ejemplo, cuando sufrimos una quemadura, pasado el tiempo dejamos de sentir ese dolor punzante, sin embargo, si nos tocamos en la zona dañada es probable que nuevamente un simple roce que en condiciones normales no nos provocaría dolor, ahora genere daño. La alodinia puede resultar de dos condiciones diferentes:
- Incremento en la respuesta de las neuronas encargadas del dolor, ubicadas en la médula espinal (sensibilización central).
- Disminución en los umbrales de activación de los nociceptores (sensibilización periférica).
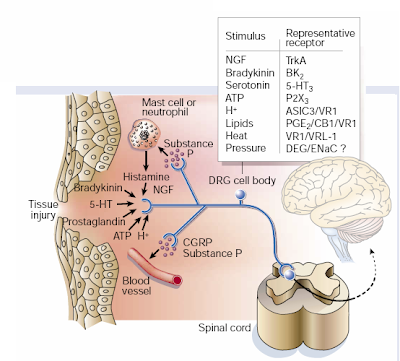
En el caso de la sensibilización central, el dolor puede ser producido por la actividad de fibras sensoriales primarias no nociceptivas. La sensación periférica en cambio, es producida cuando las terminales de los nociceptores se ven expuestas a los productos del daño e inflamación de tejidos, lo que se conoce como “sopa inflamatoria” (figura 2). Dentro de los productos que se liberan, se incluyen protones extracelulares, ácido araquidónico y otros metabolitos lipídicos, serotonina, bradiquinina, nucleótidos y NGF, todos los cuales interactúan con receptores o canales iónicos en las terminales nerviosas. Debido que los nociceptores pueden liberar péptidos y neurotransmisores (por ejemplo, sustancia P, péptido relacionado al gen de la calcitonina y ATP) desde sus terminales periféricas cuando son activados por estímulos nocivos, ellos facilitan la producción de la “sopa inflamatoria” por promover la liberación de factores desde las células no neuronales cercanas y del tejido vascular, fenómeno conocido como inflamación neurogénica.
Figura 2: Algunos de los compuestos presentes en la sopa inflamatoria. La activación de los nociceptores no sólo transmite mensajes aferentes al asa dorsal de la médula espinal (y desde aquí al cerebro) sino también inician un proceso de inflamación neurogénica. Esto es una función eferente de los nociceptores por medio del cual libera neurotransmisores, destacando la sustancia P y el péptido relacionado al gen de la calcitonina (CGRP) desde terminales periféricas induciendo la vasodilatación y la extravasación plasmática (filtración de proteínas y fluido desde vénulas y capilares), así como la activación de muchas células no neuronales, incluyendo mastocitos y neutrófilos. Estas células a su vez contribuyen con elementos adicionales a la sopa inflamatoria. Imagen tomada de Julius and Basbaum, 2001.
Los daños y lesiones incrementan la sensibilidad de los nociceptores tanto a estímulos térmicos como mecánicos. Este fenómeno resulta en parte de la producción y liberación de mediadores químicos desde las terminales sensoriales primarias y desde células no neuronales (por ejemplo, fibroblastos, neutrófilos y plaquetas) en el ambiente. Algunos componentes de la sopa inflamatoria (por ejemplo, protones, ATP, serotonina y lípidos) pueden alterar la excitabilidad neuronal directamente por interacción con canales iónicos o superficie nociceptora, mientras otros (como bradiquinina y NGF) se unen a receptores metabotrópicos y median sus efectos a través de cascadas de señalización con segundos mesajeros.
La acidosis local es la marca fisiológica de una respuesta a un daño y el grado de dolor asociado es bien correlacionado a la magnitud de la acidificación (Reeh and Steen, 1996). La aplicación de ácido (pH 5) en la piel produce la descarga de componentes de la sopa inflamatoria, en un tercio o más de los nociceptores polimodales que inervan el campo receptivo. A un nivel celular, los protones despolarizan las neuronas sensoriales por activación directa de canales catiónicos no selectivos, en los que destaca el canal TRPV1 (Bevan and Geppetti, 1994), ubicado en las terminales nerviosas libres de los nociceptores. Los protones presentan dos efectos mayores en la función de este canal:
- TRPV1 puede ser activado a temperatura ambiente cuando el pH extracelular baja de 6, es decir, cuando el ambiente se vuelve más ácido.
- protones potencian la respuesta a la capsaicina y al calor, lo que provoca que el canal se active con concentraciones más bajas de capsaicina y a temperaturas inferiores de 43 ºC .
Así, estos cambios en la conducta de TRPV1 pueden provocar un incremento en la excitabilidad de los nociceptores provocando dolor.
De los péptidos bioactivos liberados desde células no neurales en el sitio de la lesión, destaca la bradiquinina la cual, cuando se aplica a terminales nerviosas sensoriales primarias o cultivo de neuronas sensoriales, producen despolarización de membrana de forma inmediata. La bradiquinina activa el receptor acoplado a proteína G (BK2) en estas células para estimular la hidrólisis catalizada por PLC de PIP2, con la consecuente liberación de calcio desde fuentes intracelulares (figura 3) y activación de la proteína quinasa C (PKC), la cual fosforila a TRPV1 potenciando su respuesta frente a capsaicina y a protones y además reduciendo la temperatura umbral de la activación de TRPV1. Bradiquinina también aumenta la sensibilidad de TRPV1 a través de un proceso independiente de PKC. En este mecanismo, la modulación del canal ocurre como consecuencia directa de la hidrólisis de PIP2 mediante PLC, lo que libera a TRPV1 de la inhibición mediada por PIP2.
Figura 3: PIP2 es hidrolizado por la fosfolipasa C (PLC) generando IP3 y DAG. Esto inicia la liberación de calcio intracelular y la activación de la proteína quinasa C (PKC) el cual fosforilará entre otros sustratos, a TRPV1.
Finalmente cabe destacar, que estudios realizados en ratas carentes de TRPV1 señalan que éstas presentarían irregularidades en cuanto a su sensibilidad frente a acidificación severa, mientras que cultivo de sus neuronas del ganglio de la raíz dorsal, muestran una reducida respuesta a protones (Caterina et al., 2000; Davis et al., 2000). De este modo, dado el bien establecido rol de TRPV1 en la vía del dolor, se a trabajado bastante con el fin de encontrar algún antagonista que inhiba la activación de este canal para aminorar de este modo esa sensación tan incómoda que es el dolor (Krause et al., 2005). Un ejemplo de estos avances, estudia el rol de TRPV1 en la generación de dolor causado por el sarcoma de huesos (ver Sarcomas del Hueso: Los Fundamentos). La activación de osteoclastos inducen la reabsorción de los huesos y a su vez, acidosis, la cual activa los canales TRPV1 ubicados en las fibras sensoriales de los huesos, provocándonos la sensación de dolor. En un modelo in vivo del dolor de cáncer de huesos, el tratamiento de ratas con un antagonista selectivo de TRPV1 llamado JNJ-17203212 produjo una importante disminución de los movimientos evocados por el dolor (Ghilardi et al., 2005). Similarmente, otro bloqueador selectivo de TRPV1, A-425619, es mostrado por ser una efectiva solución contra el dolor en algunos modelos de nocicepción patológica e hiperalgesia térmica (McGaraughty et al., 2006). Más aún, recientemente, SB-705498 fue reportado como un antagonista de TRPV1 con una buena biodisponibilidad oral y alta efectividad en reducir hiperalgesia y alodinia en animales modelos (Rami et al., 2006; Rami et al., 2004). Estos ejemplos se han realizado hasta ahora sólo en modelos animales, pero nos hacen pensar que estos potenciales antagonistas de TRPV1 también podrían ejercer efecto en el tratamiento de diversas formas de dolor también en humanos. Otro mecanismo que se ha estudiado, es la inducción de la desensibilización de TRPV1 por desfosforilación via calcineurina. Este medio provee un mecanismo alternativo para combatir la hiperalgesia, tal como se demostró con el agonista del receptor CB1, el canabinoide WIN55,212-5 (Patwardhan et al., 2006).
Para mayor información, puedes revisar el siguiente artículo: El canal TRPV1 como diana para tratar el dolor.
Todo lo expuesto nos demuestra que TRPV1 presenta una función fundamental actuando como integrador de diversas señales nociceptivas, por lo que hoy en día, se ha vuelvo tremendamente importante estudiar los antagonistas de TRPV1, los cuales serían de gran utilidad para desvelar la contribución de este receptor en el dolor y, por supuesto también, como posibles analgésicos.
Para mayor información, puedes revisar el siguiente artículo: El canal TRPV1 como diana para tratar el dolor.



Gracias por la informacion
ResponderEliminarDe nada Alux, pronto subiré nuevas entradas sobre este tema. Por ahora estoy escribiendo un poco sobre probabilidades, para enfocarme luego en la entropía y conceptos un poco más físico químicos, pero ya estoy extrañando la fisiología.
ResponderEliminarSaludos, y gracias por leer el blog.